Data:
02/12/2020
In questo articolo vedremo come, in un soggetto affetto da lombalgia, anche il tessuto fasciale possa essere implicato nella percezione del dolore alla schiena.
“La nostra scienza ha speso più tempo sulle interazioni molecolari che comprendono il nostro funzionamento, approfondendo meno il modo in cui diamo una forma a noi stessi”. -Myers
Ormai è risaputo che la lombalgia aspecifica ha un’eziologia multifattoriale.
La letteratura attuale non supporta una causa definitiva degli episodi iniziali di lombalgia. Da un punto di vista anatomo-patologico, quindi, qualsiasi struttura innervata nella colonna lombare può causare sintomi di lombalgia.
Queste potenziali strutture sono i muscoli, i legamenti, la dura madre e le radici nervose, le articolazioni zigapofisarie, l’anulus fibroso, le vertebre e una struttura che per molto tempo è passata inosservata tanto che Carla Stecco la definisce “la struttura dimenticata”: parliamo della fascia.
Secondo l’American Heritage Stedman’s Medical Dictionary (2007), una fascia è “un foglio o una fascia di tessuto connettivo fibroso che avvolge, separa o lega insieme i muscoli, organi e altre strutture molli del corpo”.
Per decenni, lo studio del sistema muscolo-scheletrico ha avuto un approccio totalmente anatomico; vale a dire dissezionando le singole strutture che lo compongono.
D’altronde questo vuol dire anatomia, dal greco ἀνατομή «dissezione», derivazione di ἀνατέμνω «tagliare, sezionare».
Questi metodi di dissezione comuni tendono a distruggere connessioni importanti.
La fascia è, infatti, è a tutti gli effetti un sistema regolatore, come lo è il circolatorio e il nervoso; ognuno con le sue specifiche caratteristiche.
Secondo Myers, quando viene diagnosticata la sindrome del tunnel carpale, nella nostra mente viene visualizzato un nervo che chiamiamo mediano, ma questo verrà trattato all’interno del più ampio sistema nervoso. Se c’è un problema di ritorno venoso, nella nostra mente viene visualizzata una vena; questa però sappiamo che fa parte del più ampio sistema circolatorio.
Ma quando c’è una lesione ad esempio del tendine d’Achille, perché tendiamo a soffermarci solo su quella struttura, come se fosse scollegata dal più ampio sistema miofasciale?
In realtà è già dai primi anni del 2000 che si è scoperto come le fasce possano svolgere ruoli importanti di ritorno venoso, dissipazione dello stress tensionale concentrato nelle sedi di entesi, interazioni tra i muscoli degli arti, la percezione e la coordinazione del movimento, e come siano implicate nell’eziologia del dolore, tema centrale del presente articolo.
La Fascia, nella visione classica dell’anatomia, può essere compresa come componente dei tessuti molli del tessuto connettivo che permea l’intero corpo. Immaginatela come una ragnatela 3D di proteine fibrose, collose e bagnate che lega insieme e supporta circa 70 trilioni di cellule.
In questa ottica ossa e cartilagini vengono escluse dal termine “fascia” perché sono tessuti duri e inoltre, sebbene sinonimi, tessuto connettivo e fascia non sarebbero proprio la stessa cosa.
Ad oggi però, la “fascia” sembra essere accettata in una definizione più ampia comprendendo tutti i tessuti molli a base di collagene nel corpo.
Intesa in questo modo sono compresi anche tendini, legamenti, borse e tutto il tessuto dentro e intorno ai muscoli: endomisio, perimisio, epimisio.
La fascia è quindi generalmente composta da fibre di collagene a disposizione sia irregolare, che consente di gestire universalmente le forze di tensione in qualsiasi direzione, sia regolare come è nei tendini e nei legamenti. Questi specializzano quindi il tessuto per resistere alla forza massima in un numero limitato di piani, rendendosi vulnerabili a forze di tensione o di taglio in altre direzioni.
È paradossale come, nonostante la fascia sia composta dalle sostanze primarie per la vita, vale a dire acqua e proteine, sia stata tradizionalmente relegata al ruolo di tenere insieme le “parti”, e per cui tagliata solo per vedere cosa c’è sotto.
I prodotti principali nella composizione della fascia sono 3; uno ne abbiamo già accennato è il collagene, gli altri due sono elastina e reticolina (Figura 1)

Figura 1. Gli elementi principali del tessuto fasciale https://www.anatomytrains.com/fascia/
Immerse nell’acqua e in altre proteine collose interfibrillari formano la sostanza fondamentale o la matrice extracellulare, il substrato strutturale di tutte le altre cellule.
Il compito della matrice è di distribuire le tensioni garantendo contemporaneamente la forma dei diversi componenti del corpo, oltre ad essere l’ambiente chimico per le cellule che avvolge. Ricordiamo che MEC e fascia non sono la stessa cosa: la fascia contiene anche le cellule che hanno prodotto la MEC.
L’intera rete di collagene va a formare un corpo fibroso e collega il corpo in una rete senza fine, tanto che ad oggi viene utilizzato per lo più il termine di miofascia, proprio per sottolineare la natura inseparabile del tessuto muscolare e del tessuto fasciale.
Infatti, non tutte le fibre muscolari si collegano a tendine di origine e inserzione. Tali fibre sono dette no spanning e in genere si collegano al tessuto connettivo intra o extramuscolare o direttamente a fibre muscolari adiacenti.
Tramite queste strutture la forza si trasmette a endomisio perimisio ed epimisio, setti intermuscolare, membrane interossee, guaine neurovascolari e periosti. Tutte queste strutture citate fanno parte del più ampio insieme di miofascia.
La composizione collagenica della MEC non è fissa ma è legata allo stress cui è sottoposta. Questa caratteristica è di fondamentale importanza per capire come la fascia possa essere collegata al Low back pain.
La MEC si organizza, a seconda delle forze che l’attraversano, in tessuti densi o sciolti, con disposizione regolare o irregolare.
A seconda delle richieste dell’ambiente, le cellule del tessuto connettivo sono in grado di rimodellare sé stesse attraverso il fenomeno della carica piezoelettrica. In parole povere, le tensioni che passano attraverso un materiale biologico stirano le molecole producendo un leggero flusso elettrico che a sua volta stimola le cellule a modificare gli elementi intercellulari nell’area coinvolta.
È affascinante perché è qui che genetica e ambiente si incontrano: la genetica determina solo quali proteine possono essere prodotte; l’ambiente locale determina il modo in cui sono disposti di giorno in giorno.
Per questo motivo è importante sapere la funzionalità istologica di una struttura lesionata in modo da applicare il giusto carico.
Ad esempio, il menisco è composto quasi interamente da collagene tipo 1 indicando la necessità di forze di trazione piuttosto che di compressione o di taglio. I dischi intervertebrali invece necessitano di entrambi gli stimoli.
Allo stesso modo, non è possibile basarci solo sulla componente genetica ma è importante capire in cosa il paziente ha abituato il suo corpo: uno sportivo ha una disposizione della MEC diversa da un sedentario, perché gli stimoli adattativi che ha imposto sono differenti. Così come un soggetto che soffre di lombalgia cronica, avrà una disposizione diversa delle fibre da un soggetto che non è affetto, come è stato dimostrato in uno studio citato successivamente in questo articolo.
I tempi di rimodellamento della fascia sono in generale molto lenti (mesi-anni), nello specifico si differenziano tra le varie strutture miofasciali. Insomma, ogni tessuto connettivo ha i suoi tipi di fibroblasti ciascuno con le sue caratteristiche.
La fascia viene generalmente classificata in quattro tipi:
Vediamo più nel dettaglio la fascia profonda.
Questo strato di fascia circonda ossa, cartilagini, muscoli, tendini, legamenti e aponeurosi. La fascia di rivestimento si fonde perfettamente con il periostio dell’osso, con l’epimisio del muscolo scheletrico e il peritenonio di tendini e legamenti.
Forma così una rete intricata che avvolge, separa e connette queste strutture formando guaine per nervi e vasi e rinforzando i legamenti.
Le fasce profonde hanno caratteristiche diverse secondo la regione.
Ad esempio, negli arti inferiori si riscontra un volume di collagene di circa il 18% rispetto alla fibra elastica che è inferiore all’1% (Benetazzo et al, 2011). Poiché le fasce profonde degli arti non sono molto elastiche, possono trasmettere perfettamente le tensioni create dai muscoli anche a grandi distanze, passando su varie articolazioni e segmenti, e questo è funzionale alla motricità del corpo.
Nel tronco, si riconosce, la stessa struttura delle fasce profonde degli arti nella fascia toracolombare la quale ha un ruolo fondamentale nella trasmissione delle forze ascendenti e discendenti. Vi è una stretta relazione tra fascia toracolombare e muscoli del tronco implicando che il ruolo delle fasce nei movimenti non può essere separato dalle azioni dei muscoli e che, ogni volta che un muscolo si contrae, deve anche verificarsi uno stiramento spaziale della fascia corrispondente.
A conferma, Huijing et al. (2003) ha dimostrato che solo il 70% della trasmissione della tensione muscolare è diretta attraverso i tendini, che quindi gioca sicuramente un ruolo meccanico, ma viene trasmesso il 30% della forza muscolare al tessuto connettivo che circonda i muscoli, evidenziando il ruolo delle fasce profonde nella coordinazione periferica dei muscoli agonisti, antagonisti e sinergici.
Molti ricercatori hanno scoperto che alcuni muscoli hanno inserzioni fasciali; L’espansione più famosa è sicuramente il lacertus fibrosus (Figura 2), un’aponeurosi che ha origine dal tendine del bicipite e poi si fonde con la fascia antebrachiale.

Figura 2. In bianco il lacertus fibrosus del bicipite brachiale https://www.imaios.com/en
Quando i muscoli si contraggono, non solo muovono le ossa ma, grazie alle espansioni fasciali, allungano anche la fascia profonda. Le connessioni tra muscoli e le fasce sono costanti e hanno un’organizzazione precisa. La miofascia rappresenta dunque l’elemento chiave nella comprensione delle catene cinetiche.
Ma il ruolo delle fasce non finisce nella trasmissione delle forze; sono state scoperte particolari cellule chiamate miofibroblasti che permettono una contrazione indipendente della fascia dai muscoli. A differenza delle cellule muscolari, i miofibroblasti non sono sotto il controllo nervoso ma si stimolano a contrarsi attraverso tensioni meccaniche o chimiche.
Inoltre, le fasce sono in stretta relazione con il sistema nervoso; vi è un rapporto di 3:1 di fibre sensoriali situate nella fascia rispetto a quelle nel muscolo. Nella fascia troviamo per lo più meccanocettori, tra cui, corpuscoli del Pacini, corpuscoli di Ruffini, corpuscoli di Meissner e i Dischi di Merkel, tanto per citarne alcuni.
Il più grande e diffuso sistema meccanocettore miofasciale sono però i recettori interstiziali (Figura 3). In base agli stimoli che recepiscono si suddividono in due categorie:

Figura 3. Fotomicroscopia elettronica di una tipica cellula muscolare liscia all’interno della fascia crurale. In alto vi è la porzione terminale di un neurone sensoriale interstiziale non mielato.
In presenza di dolore il concentrarsi di vari neuropeptidi modifica la sensibilità di questi recettori in modo tale che anche la normale pressione fisiologica può portare al fenomeno del dolore. Ed ecco che il dolore spesso esiste senza irritazione meccanica delle strutture nervose spiegato nel “root-compression model”.
Per il trasporto di queste informazioni sensoriali si affidano in genere a fibre Aβ, Aϒ o C, contribuendo alla propriocezione. È interessante notare come la nocicezione utilizzi le stesse vie della propriocezione per essere portata e poi elaborata dai centri superiori come esperienza dolorifica.
Dunque, dolore e propriocezione sono interconnessi.
La fascia toracolombare (FTL) è stata proposta per rappresentare una possibile fonte di lombalgia idiopatica sebbene nel ruolo svolto in questo senso sia ancora scarsamente compresa.
Si intende per fascia toracolombare una fusione dei piani aponeurotici e fasciali che formano il retinacolo intorno ai muscoli paraspinali della parte bassa della schiena e regione sacrale. Questa fascia è una lamina di tessuto connettivo lassa piuttosto che fibrosa fortemente tesa sui muscoli sottostanti (Figura 4).
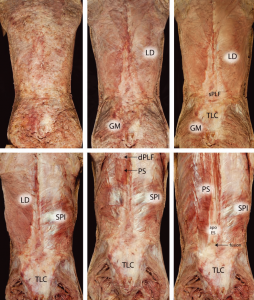
Figura 4. Da sx a dx, dissezione da superficiale a profonda della regione toracolombare. latissimus dorsi (LD); grande gluteo (GM); lamina superficiale della fascia toracolombare posteriore (sPLF); dentato posteriore inferiore (SPI); muscoli paraspinali (PS); aponeurosi dell’erettore spinale (apo ES). The thoracolumbar fascia, F. H. Willard et al. The Authors Journal of Anatomyª 2012 Anatomical Society.
Momenti e forze di reazione generate dai muscoli e dalle loro strutture passive si combinano per fornire equilibrio a molteplici gradi di libertà della colonna lombare e articolazioni sacroiliache.
La FTL è una parte fondamentale di una cintura miofasciale che circonda la parte inferiore del busto, giocando un ruolo importante nella postura, trasferimento del carico tra i muscoli del tronco e la colonna vertebrale e nella respirazione.
Una caratteristica importante di questa complessa struttura fasciale è che è composta da diversi strati di tessuto connettivo denso separato da strati di tessuto areolare che consente agli strati densi adiacenti di scivolare l’uno accanto all’altro.
Infatti, uno strato di acido ialuronico prodotto da fibroblasti specializzati, chiamati “fasciaciti“, è stato identificato all’interno del tessuto connettivo lasso, posto tra i substrati della fascia profonda, e tra la stessa fascia profonda e il tessuto muscolare. Questo strato aiuta i diversi substrati fasciali allo scorrimento, ma questo sarebbe compromesso in caso di alterazione della densità dello strato creando tensioni anomale al loro interno.
Gli strati densi corrispondono alle aponeurosi dei muscoli con differenti direzioni di tiro: ad esempio longitudinale (per gran dorsale, serrato posteriore ed erector spinae) o trasversale (per obliqui interni/esterni e gran dorsale).
In uno studio di Helene M Langevin et al., pubblicato nel 2011 per BMC Musculoskeletal Disorders è stato visto come ci fosse una riduzione del 20% nello Sforzo di taglio della FTL nei soggetti con lombalgia cronica, rispetto a soggetti senza lombalgia. Questa riduzione può essere dovuta a schemi di movimento del tronco anormali e/o patologia del tessuto connettivo intrinseco.
Un’altra evidenza di come FTL possa essere coinvolta nella percezione del low back pain (LBP) si evince dallo studio della stessa ricercatrice sopra menzionata, svolto due anni prima, nel 2009.
Lo studio ha svolto un confronto ecografico (Figura 5) del tessuto connettivo perimuscolare nella regione lombare in un gruppo di soggetti con LBP cronico o ricorrente per più di 12 mesi, rispetto a un gruppo di soggetti senza LBP.

Figura 5. Esempi di immagini ecografiche che illustrano la morfologia del tessuto connettivo perimuscolare sottile (A), spesso (B) e multistrato (C). Helene M Langevin et al. BMC Musculoskeletal Disorders 2009.
Sono stati presi in esame 107 soggetti (60 con LBP e 47 senza LBP), le immagini sono state acquisite bilateralmente centrate su un punto posto a 2 cm lateralmente al punto medio del legamento interspinale L2-L3.
Il gruppo LBP aveva uno spessore perimuscolare maggiore del 25% circa rispetto al gruppo No-LBP. Il tessuto connettivo della schiena è più spesso e più disorganizzato a seguito di rimodellamento, infiammazione cronica, fibrosi e/o infiltrazione di grasso.
Una conseguenza potenzialmente importante di ciò può essere lo sviluppo di fibrosi e aderenze, causando perdita di indipendenza nel movimento degli strati di tessuto connettivo adiacenti che potrebbe limitare ulteriormente i movimenti del corpo.
La domanda che dobbiamo porci è: un connettivo anormale della fascia toracolombare, può essere un fattore predisponente per LBP?
Attualmente, la letteratura scientifica ha dimostrato la presenza di terminazioni nervose libere nocicettive all’interno della fascia. Questo indica che può trasportare questo tipo di informazioni e inoltre alcuni studi sembrano mostrare cambiamenti morfologici nei pazienti con lombalgia cronica, tuttavia non è ancora chiaro come queste caratteristiche siano correlate all’eziologia del dolore.
È interessante notare che la distribuzione e la densità di fibre CGRP-positivo in diversi tessuti è tre volte maggiore nella FTL che nei muscoli spinali.
Il CGRP (Calcitonin Gene Related Peptide, peptide correlato al gene della calcitonina) è un peptide composto da 37 amminoacidi che facilita la trasmissione nocicettiva del dolore.
Non c’è dubbio quindi che questa fascia mostra una densa innervazione con afferenze nocicettive.
Panjabi ha proposto che le microlesioni in i tessuti connettivi lombari possono essere un fattore che contribuisce a lombalgia idiopatica.
Bednar et al. ha esaminato l’istologia dei campioni dallo strato posteriore della fascia toracolombare, che era stato ottenuto durante la chirurgia lombare da 24 pazienti affetti da dolore alla schiena. I pazienti inclusi non erano stati sottoposti in precedenza chirurgia lombare. Microscopia ottica ed elettronica del tessuto dei campioni hanno rivelato frequenti cambiamenti microscopici suggestivi di ischemia o processi infiammatori.
Un meccanismo fisiopatologico plausibile è quindi che l’infiammazione dei tessuti locali in corso combinata con anomalie dei movimenti correlate al dolore può portare a fibrosi del tessuto connettivo, aumento della rigidità dei tessuti e ulteriore compromissione del movimento che può contribuire alla cronicità del LBP.
Jan Wilke afferma che vi sono tre possibili meccanismi attraverso i quali la fascia toracolombare possa essere implicata nel dolore alla schiena:
Recenti studi di anatomia hanno evidenziato la presenza di una continuità tra fascia toracolombare e fascia profonda degli arti.
Secondo questi studi, la lamina posteriore della FTL prosegue distalmente con la fascia gluteo e la fascia lata, mentre incorpora il trapezio e il gran dorsale prossimalmente. Ha quindi un’espansione miofasciale più distale all’interno della fascia brachiale.
Diverse espansioni miofasciali più distali garantiscono una continuità anatomica fino a mani e piedi. Si suggerisce quindi di prendere in considerazione una disfunzione del tessuto miofasciale non strettamente contigua all’area sintomatica tra le cause della lombalgia aspecifica.
Questo non solo per la continuità anatomico-funzionale, ma anche per le evidenze sulla sensitizzazione centrale del dolore, discussa più avanti.
Una riduzione dei movimenti lombari quotidiani nella parte bassa della schiena, sintomo principale nei soggetti con LBP, possono incidere sulle alterazioni tissutali, creando un circolo vizioso del dolore.
A questo punto dovremmo chiederci se sia nato prima l’uovo o la gallina? Vale a dire, i cambiamenti tessutali osservati sono una causa o una conseguenza della lombalgia?
Non è ancora chiara la risposta a questa domanda anche se a mio avviso entrambe le risposte sono contemporaneamente vere e false. Ricordiamo che la lombalgia aspecifica per definizione non segue la logica di una sola causa, ma riporta la sua eziologia come multifattoriale.
Nonostante ciò, sembra davvero essere così implicata la fascia da essere entrato in uso nel linguaggio scientifico, il cosiddetto dolore miofasciale.
Recentemente la IASP ha fornito una più accurata definizione di dolore: “un’esperienza emotiva e sensoriale spiacevole causata o che sembrerebbe essere causata, da un danno tissutale, in atto o potenziale” (2020).
Tra i tessuti posti sotto studi, sta prendendo molto valore quello miofasciale, tanto da definire una “sindrome da dolore miofasciale”. Il termine “miofasciale” sta ad indicare che, sia i muscoli che la fascia, potrebbero contribuire al sintomo. Il termine sindrome, in medicina, indica un complesso più o meno caratteristico di sintomi, senza però un preciso riferimento alle sue cause e al meccanismo di comparsa.
La sindrome miofasciale dunque, è un disturbo caratterizzato dalla presenza di punti trigger miofasciali (MTrP) che si trovano nella fascia, nei tendini e / o nei muscoli, che si traducono in una risposta al dolore sintomatica.
Sono punti iperirritabili associato a un nodulo palpabile ipersensibile in una banda tesa (Figura 6). Il punto è doloroso alla compressione e può provocare dolore riferito caratteristico, disfunzione motoria e fenomeni autonomici.
Vi sono due tipologie di MTrP: attivo o latente.
Un MTrP attivo è clinicamente associato a dolore spontaneo nel tessuto circostante immediato e / o a siti distanti in specifici modelli di dolore riferiti. La forte pressione digitale sul MTrP attivo esacerba il dolore spontaneo del paziente e imita l’esperienza dolorosa familiare del paziente.
Gli MTrP classificati come latenti, sono fisicamente presenti ma non responsabili a un disturbo spontaneo del dolore. Tuttavia, la pressione sul MTrP latente provoca dolore locale nel sito del nodulo.
L’uso corrente del termine “sindrome” implica una condizione specifica che si distingue da altri disturbi del dolore dei tessuti molli come fibromialgia, tendinite o borsite. Si presenta come dolore regionale, a volte con dolore riferito, spesso accompagnato da aumento della tensione e diminuzione della flessibilità.
Caratteristica è l’ischemia locale, che porta ad un pH acido e un successivo rilascio di diversi mediatori infiammatori nel tessuto muscolare.
Recenti ricerche sostengono che i MTrP possono essere uno tra i fattori più comuni scatenanti la lombalgia.

Figura 6. Complesso di punti trigger in una fascia muscolare tesa composto da più nodi di contrazione. Jay P. Shah et al., Myofascial Trigger Points Then and Now: A Historical and Scientific Perspective. PM R. 2015.
Nonostante la volontà di sostenere i trigger point come meccanismo del dolore miofasciale, vi sono molte controversie.
Non ci sono criteri diagnostici ben accettati oltre la palpazione; il meccanismo fisiopatologico non è del tutto compreso; è associato a una innumerevole varietà di condizioni cliniche di dolore muscolo-scheletrico, il che lo rende altamente aspecifico; la natura dei sintomi dipende fortemente dalla percezione dell’individuo, dunque è difficile standardizzarlo.
Un meccanismo fisiopatologico di base è stato “The Cinderella hypothesis” il quale fornisce una possibile spiegazione del ruolo del muscolo nello sviluppo di MTrP.
Secondo questa ipotesi schemi di reclutamento muscolare durante sforzi moderati o bassi ma prolungati abitualmente come quelli “posturali” durante lo svolgimento di attività a bassa intensità della vita quotidiana e del lavoro sedentario, sono all’origine del dolore miofasciale quando le fibre muscolari che si attivano per prime sono anche le ultime a disattivarsi. Come Cenerentola, lavorano sempre e non hanno tempo sufficiente per riprendersi.
Questi tipi di sforzi sono tipicamente utilizzati da professionisti come impiegati, musicisti e dentisti.
Questa proprietà rende le fibre “Cenerentola” più suscettibili ai danni muscolari e alla disregolazione del calcio, fattori chiave nella formazione degli MTrP.
Si sposa a pennello con la teoria della crisi energetica di Simons (Simons et al., 1999).
Per rilasciare la contrazione, l’ATP è necessario per causare il cambiamento conformazionale delle fibre muscolari e pompare attivamente il calcio nel reticolo sarcoplasmatico. Se una mancanza di ATP perpetua la contrazione è concepibile che possano verificarsi ischemia, ipossia e sintesi insufficiente di ATP nelle fibre dell’unità motoria di tipo I, responsabili dell’aumento dell’acidità, dell’accumulo di Ca2 + e della successiva contrattura del sarcomero.
L’aumento della domanda e la riduzione dell’offerta di ATP forma la crisi energetica, che può provocare il rilascio di sostanze neuroreattive e sottoprodotti metabolici sensibilizzatori dei nocicettori (sensibilizzazione periferica).
Inoltre, è stato riscontrato che le afferenze a piccole fibre non mielinizzate mostrano proprietà neurosecretorie retrograde simili alle fibre simpatiche, coinvolgendo un processo noto come infiammazione neurogena.
Il bombardamento continuo dell’attività afferente primaria nel tempo può portare a funzioni anormali e cambiamenti strutturali nei gangli della radice dorsale e nei neuroni del corno dorsale, processo noto come sensibilizzazione centrale, caratterizzata da incremento del campo recettoriale e abbassamento della soglia di eccitazione.
Su questi neuroni, però, confluiscono anche via afferenti somatiche e viscerali.
Questi si ritrovano a dover affrontare un carico allostatico anomalo in una condizione anomala; anche stimoli fisiologici sono interpretati come nocicettivi causando alterazioni tissutali come atrofia dei muscoli stabilizzatori lombari.
Dopo aver attivato i neuroni ad ampio intervallo dinamico WDR, l’input afferente da MTrP attivi sale quindi nel tratto spinotalamico per raggiungere i centri cerebrali più alti.
Oltre ad attivare il talamo, l’input afferente muscolare attiva preferenzialmente il sistema limbico (cioè il giro cingolato anteriore, insula e amigdala), che svolge un ruolo critico nel modulare il dolore muscolare e la componente emotiva o affettiva del dolore persistente. Una maggiore attività nel sistema limbico porta a maggiore paura, ansia e stress.
Uno studio ha mostrato una riduzione della materia grigia dell’area limbica in pazienti con sindrome da dolore miofasciale (Bordoni et al., 2020).
Sappiamo quanto è complesso parlare di low back pain e abbiamo visto che ultimamente la ricerca abbia dimostrato come anche il tessuto fasciale possa essere implicato nella percezione del dolore alla schiena.
Nella pratica, sapere che ci può essere questa componente in un soggetto affetto da LBP può aiutarci nell’impostare un corretto trattamento.
Laddove si riscontrino punti trigger e ci sia l’ipotesi di dolore miofasciale, personalmente mi affido a chi ha competenza con tecniche osteopatiche, mentre io utilizzo il self myofascial realease ed esercizi di “stretching dinamico”, attraverso movimenti globali che richiamano la funzionalità del meridiano miofasciale a cui appartine l’unità “dolente” in cui si sono riscontrati punti trigger.
L’esercizio fisico attivo e costante è una strategia efficace nel trattamento del dolore miofasciale. Migliora la gamma di movimento, l’umore, la soglia del dolore e riorganizza la disposizione della MEC.
Vuoi ricevere contenuti pratici e sempre aggiornati, come quelli citati in questo articolo? Allora non ti resta che diventare uno dei membri della nostra University Lab!
Dai anche un’occhiata ai nostri corsi di formazione pensati per i Professionisti del Movimento!
Simone Antonielli
Note sull’autore
Laurea triennale in Scienze Motorie e Sportive, Università degli studi dell’Aquila
Laurea magistrale in Scienze Motorie Preventive e Adattative, Università degli studi dell’Aquila
Certificazione “Functional and postural recovery” presso Training Lab Italia
Certificazione “Strenght and Conditioning Buzzichelli edition” presso Training Lab Italia
Myofascial Trigger Points Then and Now: A Historical and Scientific Perspective Jay P. Shah, MD, Nikki Thaker, BS, Juliana Heimur, BA, Jacqueline V. Aredo, BS, Siddhartha Sikdar, PhD, and Lynn H. Gerber, MD. PM R. 2015.
Fascial plasticity – a new neurobiological explanation: Part 1. Robert Schleip. Journal of bodywork and movement therapies january 2003.
Fascial plasticity – a new neurobiological explanation Part 2. Robert Schleip. Journal of bodywork and movement therapies january 2003.
Ultrasound evidence of altered lumbar connective tissue structure in human subjects with chronic low back pain Helene M Langevin, Debbie Stevens-Tuttle, James R Fox, Gary J Badger, Nicole A Bouffard, Martin H Krag, Junru Wu and Sharon M Henry, BMC Musculoskeletal Disorders 2009.
Reduced thoracolumbar fascia shear strain in human chronic low back pain Helene M Langevin, James R Fox, Cathryn Koptiuch, Gary J Badger, Ann C Greenan- Naumann, Nicole A Bouffard, Elisa E Konofagou, Wei-Ning Lee, John J Triano and Sharon M Henry. BMC Musculoskeletal Disorders 2011.
The Lumbodorsal Fascia as a Potential Source of Low Back Pain: A Narrative Review. Jan Wilke, Robert Schleip, Werner Klingler, and Carla Stecco. BioMed Research International 2017.
Role of fasciae in nonspecific low back pain Gulia Casato, Carla Stecco, Riccardo Busin. Eur J Transl Myol 2019.
The fascia: the forgotten structure Stecco Carla, Macchi Veronica, Porzionato Andrea, Duparc Fabrice, De Caro Raffaele. Italian journal of anatomy and embryology 2011.
Not merely a protective packing organ? A review of fascia and its force transmission capacity. Jan Wilke, Robert Schleip, Can A. Yucesoy, and Winfried Banzer. J Appl Physiol 2018.
The thoracolumbar fascia: anatomy, function and clinical considerations F. H. Willard, A. Vleeming, M. D. Schuenke, L. Danneels and R. Schleip. J. Anat. 2012.
Myofascial Low Back Pain Ryan R. Ramsook & Gerard A. Malanga. Curr Pain Headache Rep 2012.
Myofascial Pain. Bruno Bordoni; Kavin Sugumar; Matthew Varacallo. StatPearls Publishing; 2020.
I MIGLIORI CORSI PER STUDENTI E LAUREATI IN SCIENZE MOTORIE
Scopri i prossimi corsi e scegli quello che fa per te!
I MIGLIORI CORSI PER STUDENTI E LAUREATI IN SCIENZE MOTORIE
Scopri i prossimi corsi e scegli quello che fa per te!
I MIGLIORI CORSI PER STUDENTI E LAUREATI IN SCIENZE MOTORIE
Scopri i prossimi corsi e scegli quello che fa per te!
Training Lab News
TRAINING LAB ITALIA - S.R.L.S.
P.IVA 02202690687
Richiedi il tuo codice sconto del 10% su tutti i nostri corsi.